2017/03/02
ガン増殖を引き起こすタンパク質Sin1の構造を明らかに
分裂酵母の研究が新たな抗ガン剤創薬への扉を開く
【概要】
奈良先端科学技術大学院大学(奈良先端大 学長:小笠原直毅)バイオサイエンス研究科の塩﨑一裕教授、建部恒助教、横浜国立大学大学院工学研究院の児嶋長次郎教授(大阪大学蛋白質研究所特任研究員)らの共同研究グループは、ヒト発ガンの主因の一つであるAKTというタンパク質に結合してその活性化を制御するタンパク質複合体の仕組みについて、その中のSin1と呼ばれるタンパク質が結合する部位の構造を世界で初めて明らかにしました。
ヒトの様々な臓器での発ガンにおいて、AKTと呼ばれるタンパク質の働きが異常なまでに活発になることが細胞ガン化の主因の一つとなっています。このAKTに直接作用し、その働きを活発にする作用を持つTORC2と呼ばれるタンパク質複合体は、AKTの働きを抑制する抗ガン剤創薬の有望な標的因子になると期待されていますが、TORC2を特異的に阻害する薬剤は未だに存在しません。
今回、ヒトと同じくTORC2及びAKTを持ち、遺伝学による研究の容易な分裂酵母を活用し、TORC2複合体に含まれるSin1タンパク質のCRIM(Conserved Region In the Middle;進化的に保存された中央領域)と呼ばれる領域がAKTと直接結合することにより、TORC2がAKTの働きを活発にすることを明らかにするとともに、CRIM領域の立体構造を解明しました。
本研究では、Sin1タンパク質CRIM領域とAKTとの直接結合を阻害する薬剤の開発により、AKTを抑制する新しいタイプの抗がん剤への道が開かれる事が示されました。また、今回の研究で解明したCRIM領域のタンパク質立体構造は、TORC2特異的抗ガン剤創薬の鍵になると期待されます。
今回の研究成果は、日本時間 3月7日(火)午前9時1分に英国の学術誌eLIFEに掲載されます。
【掲載論文】
タイトル: Substrate specificity of TOR complex 2 is determined by a ubiquitin-fold domain of the Sin1 subunit [和訳:TOR複合体2(TORC2)の基質特異性はSin1サブユニットのユビキチン様ドメインによって決定される]
著者: Hisashi Tatebe1, Shinichi Murayama1, Toshiya Yonekura1, Tomoyuki Hatano1, David Richter2, Tomomi Furuya1, Saori Kataoka3, Kyoko Furuita3, Chojiro Kojima3,4 and Kazuhiro Shiozaki1,2
所属: 1奈良先端科学技術大学院大学、2カリフォルニア大学デービス校(米国)、3大阪大学、4横浜国立大学
掲載誌: eLIFE - 米国ハワード・ヒューズ医学研究所、英国ウェルカム・トラスト、独国マックス・プランク研究所の支援により2012年に新しく創刊された、生命科学・医学分野を対象とした非営利・オープンアクセスの学術誌です。
DOI: 10.7554/eLife.19594 ( http://dx.doi.org/10.7554/eLife.19594 )
naistar:http://hdl.handle.net/10061/11391(NAIST Academic Repository:naistar)
【本研究の実験手法と結果】
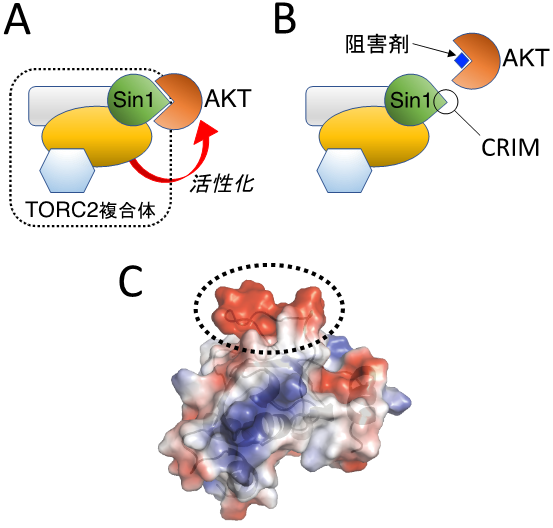
AKTに相当する分裂酵母タンパク質(Gad8と呼ばれています)に結合するタンパク質を探索したところ、Sin1が直接結合することを発見しました。この発見を手がかりとして、ヒトSin1とAKTについても検討した結果、両者は直接結合を示しました。さらに解析を進め、分裂酵母、ヒトの両生物種において共に、Sin1タンパク質中のCRIM(Conserved Region In the Middle;Sin1タンパク質中央に進化的に保存された領域)とよばれる領域がAKTと直接結合することを明らかにしました。そこで、CRIM領域のタンパク質立体構造を核磁気共鳴(NMR)分光法(※2)により決定したところ、CRIM領域に特徴的な突起が見つかり、この突起を人為的に損なうと、Sin1とAKTは結合できなくなり、AKTの活性化を抑制できることが明らかになりました。
【本研究で得られた結論とその意義】
本研究の結果から、TORC2がAKTの働きを活発にする上で、Sin1タンパク質CRIM領域とAKTとの直接結合が決定的な役割を果たす事が証明されました。このことは、CRIM領域とAKTとの直接結合を特異的に阻害する薬剤の開発により、AKTを抑制する新しいタイプの抗がん剤への道が開かれる事を意味しています。本研究で解明したCRIM領域の原子レベルでの詳細な立体構造は、そのような薬剤化合物の設計・探索に欠かすことのできない情報となります。
本研究は、文部科学省及び日本医療研究開発機構「創薬等支援技術基盤プラットフォーム事業」、文部科学省(日本学術振興会)科学研究費補助金、三菱財団、第一三共生命科学研究振興財団、アステラス病態代謝研究会、佐川がん研究振興財団(現SGH財団)、米国国立衛生研究所の支援により行われました。
【用語解説】
※1 分裂酵母(学名 Schizosaccharomyces pombe;スキゾサッカロミセス・ポンベ):19世紀末に、アフリカ産の雑穀ビールから発見された酵母菌の一種です。学名のpombeはスワヒリ語でビールを意味します。生命科学研究の分野では重要な生物種の一つで、研究が容易な単純な単細胞生物でありながら、複雑な多細胞生物であるヒトにまで共通する性質を多く進化的に保存している事で知られています。
※2 核磁気共鳴(NMR)分光法(Nuclear Magnetic Resonance spectroscopy):タンパク質分子に含まれる水素、炭素、窒素等の原子核の核磁気共鳴スペクトルを測定することで溶液中のタンパク質の立体構造を決定する手法です。タンパク質立体構造解析の代表的な手法であるX線結晶構造解析法と比較して、結晶化を必要としない利点があります。
【本研究内容についてコメント出来る方】
広島大学健康長寿研究拠点・英国フランシスクリック研究所
教授 登田 隆(とだ たかし) E-mail: takashi-toda@hiroshima-u.ac.jp
【本プレスリリースに関するお問い合わせ先】
奈良先端科学技術大学院大学 バイオサイエンス研究科 細胞シグナル研究室
塩﨑 一裕 教授 、TEL: 0743-72-5540、E-mail: kaz@bs.naist.jp
建部 恒 助教、TEL: 0743-72-5541、E-mail: htatebe@bs.naist.jp
横浜国立大学 大学院工学研究院 生物物理化学・構造生命化学研究室
(大阪大学 蛋白質研究所 機能構造計測学研究室)
児嶋 長次郎 教授(特任研究員)
横浜国立大学 TEL: 045-339-4232、E-mail: kojima-chojiro-xk@ynu.ac.jp
(大阪大学 TEL: 06-6879-8598、E-mail: kojima@protein.osaka-u.ac.jp)
【参考図】
(A) AKTがTORC2複合体中のSin1に結合すると、TORC2がAKTを活性化する。
(B) Sin1とAKTとの結合阻害剤により、TORC2によるAKT活性化の抑制が可能となる。
(C) AKTと直接結合するSin1タンパク質CRIM領域の立体構造。CRIM領域に特徴的な負電荷に富んだ突起を点線で囲んである。