研究成果 2019/08/13
奈良先端科学技術大学院大学(学長:横矢直和)先端科学技術研究科 物質創成科学領域の超分子集合体科学研究室 廣田俊教授、太虎林特任助教(現:中国中山大学特聘副研究員)の研究グループと、兵庫県立大学(学長:太田勲)生命理学研究科の樋口芳樹教授、及び中山大学(学長:羅俊)の毛宗万教授の共同研究グループは、水素エネルギーの利用に不可欠な水素分子を分解したり、合成したりする反応を高効率で可逆的に触媒する酵素(ニッケル-鉄ヒドロゲナーゼ)について、触媒反応のキーポイントとなる水素イオン輸送のメカニズムを初めて明らかにした。この酵素に含まれるニッケル原子に結合したシステインというアミノ酸の残基や、その近傍のグルタミン酸(アミノ酸)の残基、さらに酵素内部に固定化された水分子の3つが協同して水素イオンの輸送を行っていた。この酵素による触媒反応の効率は、現在の燃料電池に使われている白金等の希少金属触媒を上回る。今回の成果は、新たな方式の燃料電池や水素合成触媒の開発につながる研究と期待されている。
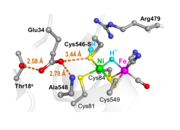
ニッケル-鉄ヒドロゲナーゼは微生物が持つ水素分解・合成酵素である。酵素中の触媒反応を司る中心部分は、ニッケルと鉄原子からなる金属錯体といわれる結合パターンで、ニッケル-鉄活性部位と呼ばれる。触媒反応が起こる時、水素分子の分解反応では2つの水素イオンと2つの電子が生じ、逆に水素分子の合成反応では2つの水素イオンと2つの電子が消費され、電子については鉄硫黄クラスターという原子の集まりを通って外部のタンパク質分子とやり取りされることは分かっていたが、触媒反応に関わる水素イオンの輸送経路は不明のままであった。
廣田教授らは、フーリエ変換赤外吸収分光法という分子構造を調べる方法を用いた。これまでにない超高感度で幾つかの中間体の赤外吸収スペクトルを測定し、ニッケル原子に結合しているシステイン残基の硫黄原子に水素イオンが結合したり、逆に解離したりする様子を初めて観測することに成功した。さらに、グルタミン酸残基に水素イオンが付加する現象や水素分子から生じる水素イオンを取り込んだ水分子も観測できた。これにより、分解のときは、水素分子から生じる水素イオンが反応部位(ニッケル-鉄活性部位)からその外へ(水素分子を合成するときは水素イオンが反応部位内へ)輸送されるメカニズムが明らかとなった。
この成果は、8月13日にドイツの「Angewandte Chemie International Edition(アンゲバンテ・ケミー・インターナショナル・エディション)」のオンライン版で最終版が掲載されました。